醫用化學/酸堿反應
| 醫學電子書 >> 《醫用化學》 >> 電解質溶液 >> 酸堿質子理論 >> 酸堿反應 |
| 醫用化學 |
|
|
酸堿質子理論中的酸堿反應是酸堿之間的質子傳遞。例如:
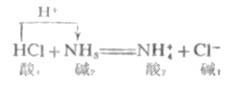
這個反應無論在水溶液中、苯或氣相中,它的實質都是一樣的。HCL是酸,放出質子給NH3,然后轉變成共軛堿CL-,NH3是堿,接受質子后轉變成共軛酸NH4+。強堿奪取了強酸放出的質子,轉化為較弱的共軛酸和共軛堿。
酸堿質子理論不僅擴大了酸堿的范圍,還可以把酸堿離解作用、中和反應、水解反應等,都看作是質子傳遞的酸堿反應。
由此可見,酸堿質子理論更好地解釋了酸堿反應,擺脫了酸堿必須在水中才能發生反應的局限性,解決了一些非水溶劑或氣體間的酸堿反應,并把水溶液中進行的某些離子反應系統地歸納為質子傳遞的酸堿反應,加深了人們對酸堿和酸堿反應的認識。但是酸堿質子理論不能解釋那些不交換質子而又具有酸堿性的物質,因此它還存在著一定的局限性。
路易斯提出的酸堿電子理論是目前概括最廣的酸堿理論。該理論認為,凡是能給出電子對的物質叫做堿;凡是能接受電子對的物質叫做酸。即酸是電子對的接受體,堿是電子對的給予體。因此,堿中給出電子的原子至少有一對孤對電子(未成鍵的電子對),而酸中接受電子的原子至少有一個空軌道(外層未填充電子的軌道),以便接受堿給予的電子對,這種由路易斯定義的酸和堿叫做路易斯酸和路易斯堿。例如,三氟化硼(BF3)是路易斯酸,因為BF3中的B原子有一個空軌道是電子的接受體。NH3中N原子有一對孤對電子,是電子對的給予體,為路易斯堿。但是,由于酸堿電子理論概括的酸堿范圍太寬,使其實用價值受到一定的限制。
出自A+醫學百科 “醫用化學/酸堿反應”條目 http://www.crossoverdream.com/w/%E5%8C%BB%E7%94%A8%E5%8C%96%E5%AD%A6/%E9%85%B8%E7%A2%B1%E5%8F%8D%E5%BA%94 轉載請保留此鏈接
| 關于“醫用化學/酸堿反應”的留言: | |
|
目前暫無留言 | |
| 添加留言 | |